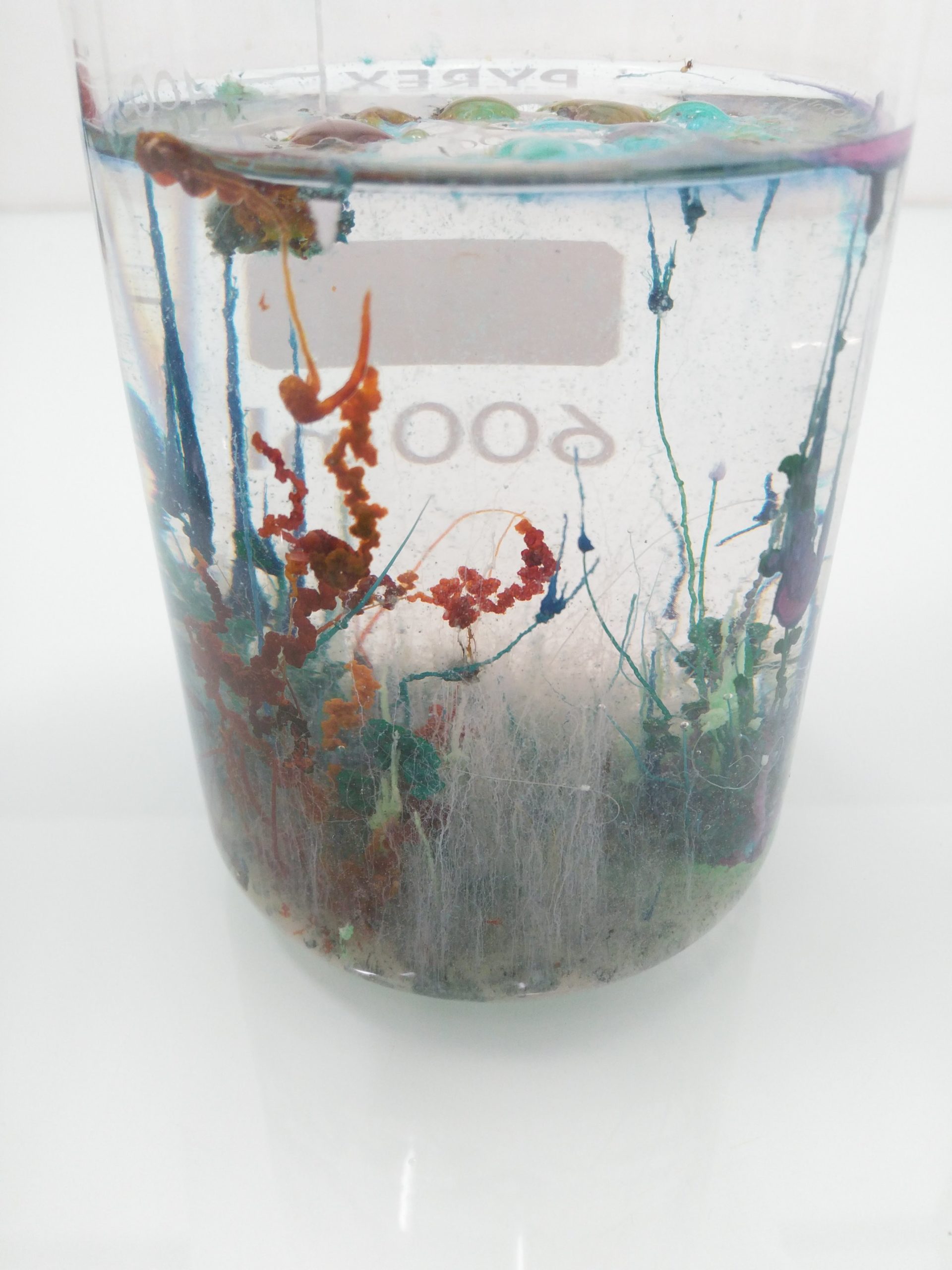Comment utiliser et entretenir les électrodes pH verre ?
L’entretien des électrodes pH est primordial si l’on veut que leur durée de vie et leur précision, soient au maximum de leurs capacités.
La durée de vie d’une électrode pH est fonction de sa contenance en électrolyte et de son bon entretien. Une électrode peut tenir quelques semaines à maximum 3 ans en général.
Une électrode qui n’est pas entretenue va donner un signal lent à se stabiliser et les mesures deviendront aussi moins précises.
Tout d’abord, rappelons que le pH mesure l’acidité ou la basicité d’une solution aqueuse. C’est donc une mesure chimique que le pH-mètre effectue par la différence de potentiel entre deux électrodes.
Lors de la réception de votre commande d’électrode, notez la date, puis commencez par la rincer à l’eau afin d’enlever les traces de sels qui sont apparus suite à l’évaporation du KCl contenu dans le capuchon. N’hésitez pas à la secouer légèrement pour être certain de ne pas avoir de bulles d’air coincées dans la boule.
Lorsque vous sortez l’électrode pour la première fois, ou que vous revenez de vacances d’été, faites tremper votre électrode 4 à 6h dans un bécher d’eau du robinet et remplissez, si besoin, le niveau d’électrolyte jusqu’à environ 3-4mm en dessous de l’orifice de remplissage avec une solution de KCl à environ 3 mol.L-1.
L’électrode pH ne doit absolument pas sécher. Si c’est le cas la mesure va petit à petit dériver et donner des valeurs inexactes.
L’électrode ne doit pas non plus être stockée dans de l’eau distillée car cela entraînerait l’appauvrissement en ions KCl de l’électrolyte.
Donc il conviendra de s’assurer du temps de stockage de votre électrode.
En effet, lorsqu’il s’agit d’un stockage de courte durée (le temps de préparer le TP et de l’installer par exemple), vous pouvez laisser tremper la sonde dans un bécher d’eau du robinet, et cela évitera que les élèves renversent le capuchon qui se trouve sur les électrodes lorsqu’elles sont stockées longtemps.
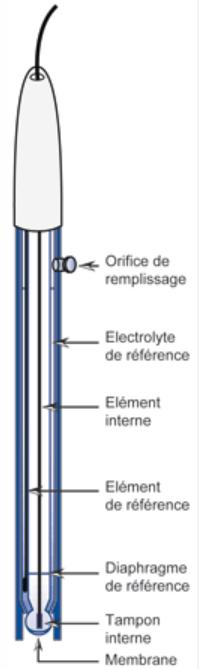
Pensez à laisser ouvert l’orifice de remplissage. Si vous observez une baisse du niveau de KCl, vous pouvez l’ajuster.
Pour un stockage de longue durée ( période de vacances d’été par exemple), remplir l’électrolyte par l’orifice de remplissage et fermer l’orifice. Vous pouvez ensuite conserver l’électrode dans le capuchon remplit d’une solution d’électrolyte comme celui présent dans l’électrode. La solution de conservation maintient l’électrode humide et assure aussi un rechargement de l’électrolyte en ions KCl.
Pour une bonne conservation, stockez votre électrode à la verticale. Ou directement à sec (mais je ne privilégie pas cette technique pour laquelle, je trouve, il est plus difficile de retrouver des électrodes fiables après un long temps sans utilisation).
Dans tous les cas, fiez-vous à la notice d’utilisation du fournisseur.
Il se peut que l’électrolyte interne ait été altéré. Pour le retirer, utilisez la seringue fournit.
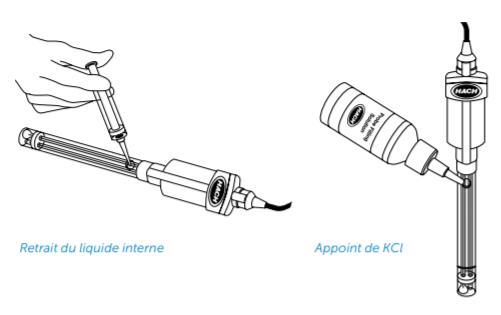
Avant chaque utilisation et entre les mesures, rincez votre électrode avec de l’eau distillée.
Il faudra également étalonner votre pH-mètre En général cela se fait en deux points pH 4 et pH 7. Parfois également à pH 10. (cf notice du fournisseur).
Pour un temps de réponse plus rapide vous pouvez laisser ouvert l’orifice de remplissage.
Si vous remarquez que votre électrode répond mal ou affiche des résultats incohérents malgré un étalonnage très bien réalisé, vous pouvez vérifier votre électrode en fonction mV. Pour cela, plongez l’électrode dans une solution pH 7 et relevez la valeur en mV (normalement entre 20 et +20 mV) puis plongez l’électrode dans une solution pH 4 et vérifiez que la différence entre la valeur à pH 7 et à pH 4 se situe dans une fourchette de 160 à 180 mV. (à vérifier avec la notice fournisseur). Si la différence entre les 2 valeurs est dans cette fourchette, votre électrode est encore utilisable. Si elle est en dehors, elle n’est plus utilisable (peut-être trop vieille par exemple)
1er exemple :
valeur lue dans pH 7 = –18 mV
valeur lue dans pH 4 = 154 mV
Différence entre les 2 valeurs = 172 mV
L’électrode est encore utilisable.
2e exemple :
valeur lue dans pH 7 = 16 mV
valeur lue dans pH 4 = 164 mV
Différence entre les 2 valeurs = 148 mV
L’électrode n’est plus utilisable car sa pente est trop faible.
Il faut nettoyer régulièrement l’électrode pH car les solutions mesurées peuvent créer un dépôt sur le bulbe de l’électrode et altérer le fonctionnement du système de mesure. Des solutions spécialement dédiées sont proposées pour nettoyer les électrodes. Attention, il ne faut pas frotter l’électrode pour la nettoyer.