voici un petit rappels sur les forces ainsi qu’une activité sur le poids et la masse…
à vous de jouer!
act p et m forces p et m
voici un petit rappels sur les forces ainsi qu’une activité sur le poids et la masse…
à vous de jouer!
act p et m forces p et m
Je vous propose un TP/Cours sur les premières notions d’utilisation de l’oscilloscope…
à vous de jouer
oscillo
Il existe plusieurs façons d’écrire une molécule :
– la formule brute : CnHmOx…
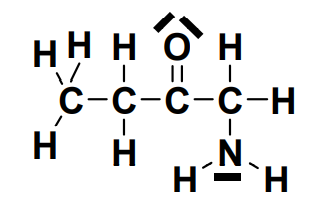
– la formule développée : on représente les électrons de valence :
– la formule semi-développée : on ne représente que les liaisons entre les atomes :
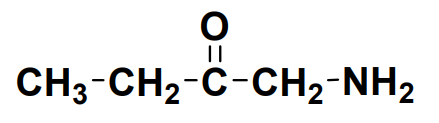
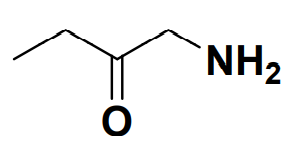
– la formule topologique : seules les fonctions sont représentées :
Pour que l’ensemble des chimistes se comprennent, il existe une nomenclature universelle qui nous donne quelques principes et règles pour nommer une molécule.
1) on identifie les fonctions de la molécule
2) on différencie les fonctions principales et secondaires (les substituants)
3) on identifie la chaîne carbonée la plus longue qui porte la fonction principale et on la numérote de façon à ce que la fonction principale ait le numéro le plus petit (devant suffixe). On utilisera le nom de l’alcane.
4) on place le nom de la fonction principale en suffixe et des fonctions secondaires en préfixe
5) on place les insaturations entre l’hydrure parent et le suffixe.
6) on place les substituants en préfixes par ordre alphabétique
Exemples:
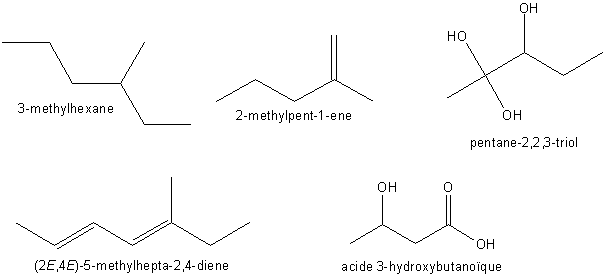
nomm
Pour les doubles liaisons, on peut également différencier 2 molécules en fonction des positions des substituants
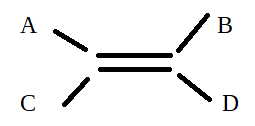
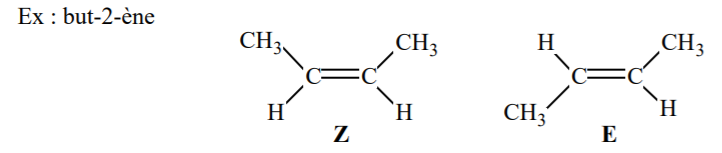
Si les 2 substituants les plus prioritaires, sont du même côté de la double liaison (tous les 2 en dessus ou en dessous) alors on parle de configuration Z (si par ex A et B sont prioritaires) . Si les 2 substituants les plus prioritaires sont l’un en dessus et l’autre en dessous de la double liaison, alors on parle de configuration E (ex: si A et D sont prioritaires).
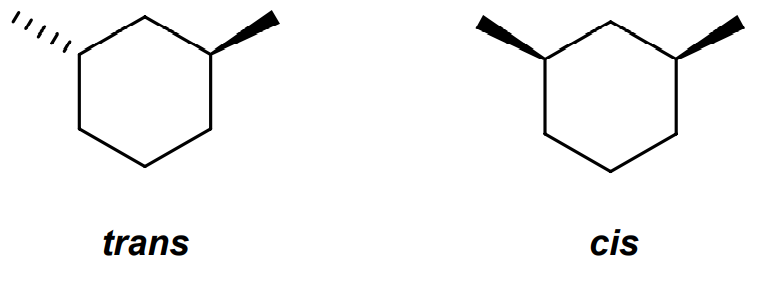
De même, pour la nomenclature des cycles il y a une règle:
Lorsque plusieurs substituants sont placés sur un cycle on peut comparer la position relative des substituants par rapport au plan moyen du cycle.
On utilisera cis si les substituants sont du même côté du plan
On utilisera trans si les substituants sont de part et d’autre de ce cycle.
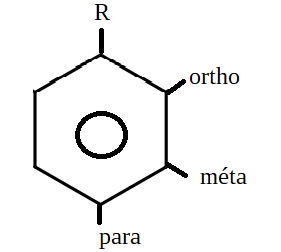
De plus, on donne au substituant principal la position « 1 » sur le cycle (R sur le schéma ci-contre). … L’isomère ortho est donc l’isomère 1,2. Un substituant secondaire en position méta sera sur l’atome suivant en position « 3 ». L’isomère méta est donc l’isomère 1,3. L’isomère para en face du substituant R sur le cycle, sera donc en position 1,4.
Méthode VSEPR
C’est la méthode de la prévision de la géométrie des molécules
VSEPR : Valence Shell Electron Pair Repulsion
Les doublets d’électrons sont assimilés à des charges électriques ponctuelles.
On fait l’approximation que les charges se déplacent sur une sphère centrée sur le noyau.
D’après la théorie de Lewis, on écrit :
AXnEm
où A= atome central, n le nombre de doublets liants et m le nombre de doublets non liants
Suivant la valeur de (n+m) les molécules adoptent des configurations géométriques différentes